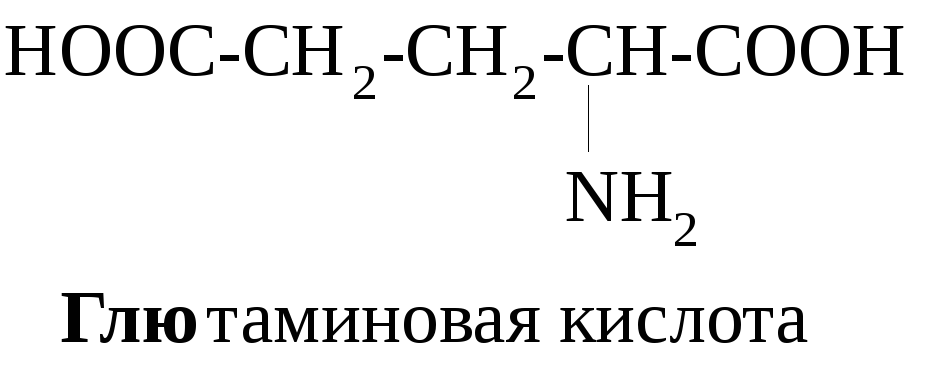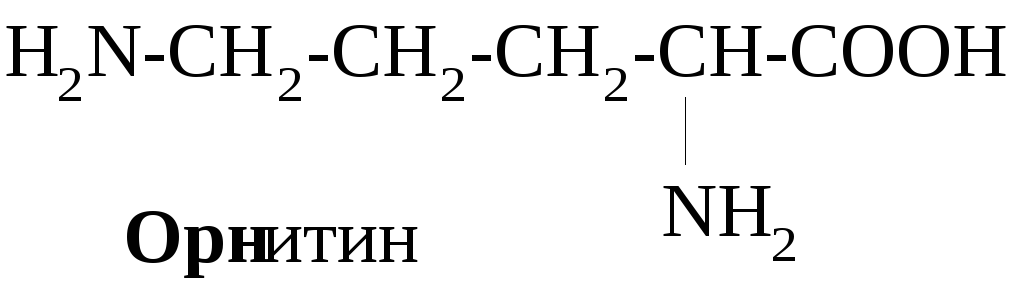Лекция №12. -Аминокислоты. Пептиды. Белки
Белки – сложные биополимеры, мономерами которых являются -аминокислоты. В составе белков в организме человека встречаются только 20-аминокислот. Белки важнейший класс биологических соединений. Они играют ключевую роль в клетке, присутствуют в виде главных компонентов в любых формах живой материи, поэтому по-прежнему неопровержимо определение Ф.Энгельса, что «жизнь есть способ существования белковых тел». Белки чрезвычайно разнообразны по структуре и выполняют многочисленные биологические функции. Так в одном организме Escherichia сolli содержится более 3000 различных белков.
Название белки получили от яичного белка, который с незапамятных времен использовался в пищу. Изучение белков, как химических соединений началось с изучения их свойств (свертываемость, разложение и т.д., поэтому одними из первых были изучены белки крови (Гарвей). Растительные белки изучали на клейковине, полученной из пшеничной муки. Первая концепция строения белков принадлежит голландскому химику Мульдеру, он сформулировал понятие о минимальной структурной единице белков и назвал ее протеином. Впервые гипотезу строения беков, как полимеров, построенных из остатков аминокислот, связанных пептидной связью выдвинул Эмиль Герман Фишер (1902)
Молекулярная масса белков варьирует от 5000 до 1млн и более. Белками являются ферменты, гормоны, антибиотики, токсины. Белки выполняют разнообразные функции: каталитические (ферменты), двигательные (актин, миозин) транспортные (гемоглобин, миоглобин, цитохромы), защитные (иммуноглобулины, антигены, фибриноген), рецепторные (родопсин), регуляторные (гистоны, репрессоры,) запасающие (козеин, овальбумин) Энергетическую функцию выполняют запасающие белки или иные в условиях длительного голодания или интенсивной длительной работы мышц.
Сравнительно небольшие молекулы с массой до 5000 называют пептидами к ни относят некоторые гормоны (вазопрессин, адренокортикотропный гормон), глюкагон, нейропептиды мозга (эндорфин), пептиды сна, памяти, и т.п., алкалоиды (эрготамин) антибиотики ( грамицидин)
I. -Аминокислоты
-Аминокислоты – гетерофункциональные соединения, молекулы которых содержат карбоксильную и аминогруппу у одного и того же атома углерода. В большинстве АК, этот атом углерода является хиральным центром, в АК, которые являются мономерами белков он имеет относительную — L конфигурацию. Конфигурация АК определяется по первому хиральному атому (-углерод).
СООН
NH2 H
В определенных условиях может происходить обращение конфигурации, так, например, под воздействием микроволнового излучения. Подобный процесс может иногда происходить самопроизвольно в течение длительного времени неферментативно. Например L-аспартат в дентине зубов при температуре тела человека со скоростью 0,01% в год превращается в D- изомер, по его содержанию можно определить возраст человека.
Все -АК имеют общий фрагмент или “стандартный блок” и отличаются радикалом у -углеродного атома. Отсутствует радикал только у глицина, у него вместо радикала атом водорода.
NH2 – СН – СООН
Источник
Природные α-аминокислоты. Пептиды, белки
α-Аминокислоты являются мономерными единицами биополимеров – пептидов и белков. Белки – основа всего живого. Функции белков в природе многообразны. Это ферменты и гормоны, выполняющие регуляторную функцию, структурные белки (кератин, коллаген), транспортные (гемоглобин), защитные (иммуноглобулины). Некоторые аминокислоты используются как лекарственные средства, например, глутаминовая кислота – при заболеваниях ЦНС, метионин – для лечения заболеваний печени, цистеин – как радиопротектор, а также в глазной практике.
В природе в свободном и связанном виде обнаружены сотни аминокислот, 20-25 из них постоянно встречаются во всех белках.
Строение и классификация природных α-аминокислот
Общая формула α-аминокислот (исключение – пролин и оксипролин):
В основном используют тривиальные названия α-аминокислот. В биохимии часто пользуются сокращенными трехбуквенными названиями.
Согласно общей формуле, аминокислоты отличаются лишь строением радикала, в соответствии с чем они классифицируются на алифатические, ароматические и гетероциклические. Среди алифатических аминокислот в зависимости от наличия в радикале функциональной группы выделяют подгруппы гидрокси- и серосодержащих аминокислот.
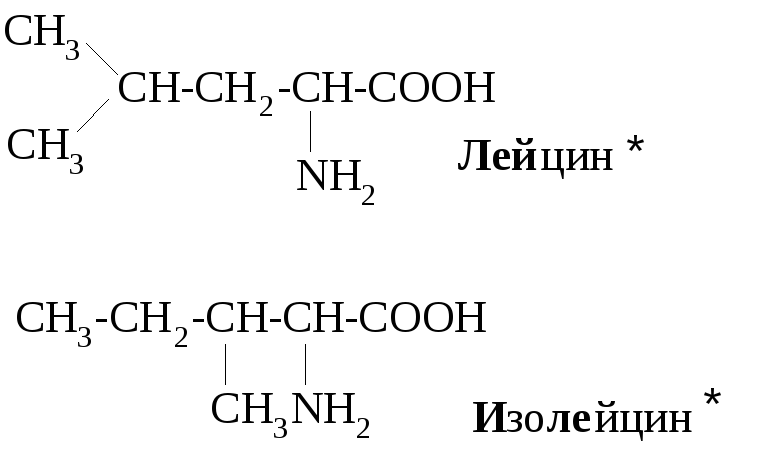
Примеры алифатических аминокислот:

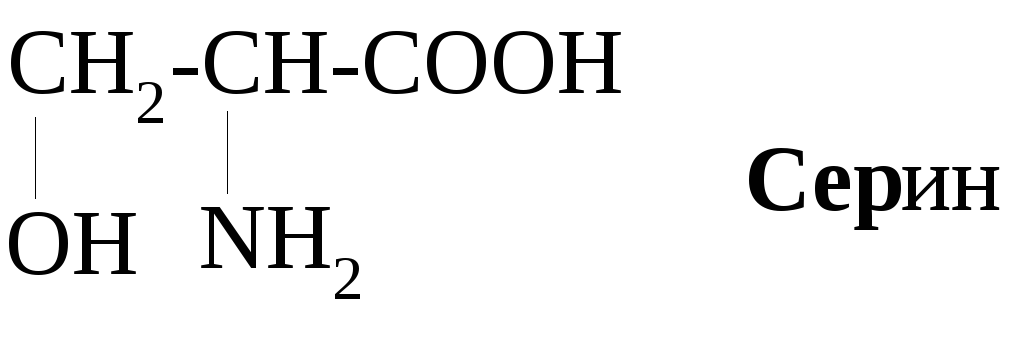


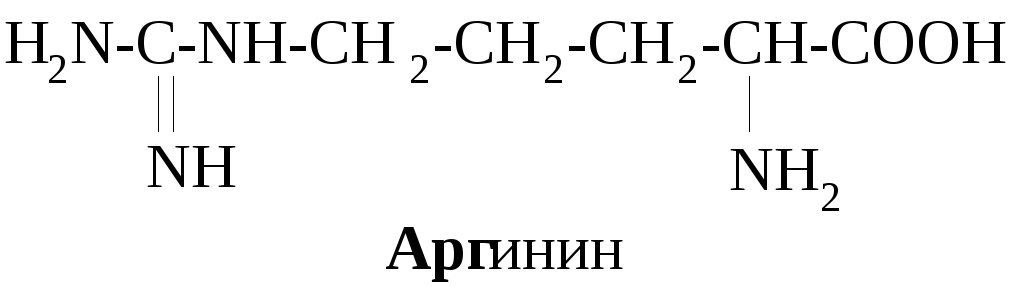
Примерами ароматических аминокислот являются фенилаланин и тирозин:
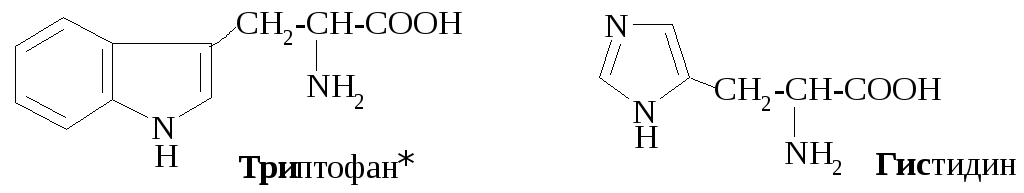
К гетероциклическим аминокислотам относятся:
В зависимости от соотношения количества карбоксильных и аминогрупп в молекулах различают нейтральные (моноаминомонокарбоновые) – глицин, аланин и др., кислые (моноаминодикарбоновые) – аспарагиновая, глютаминовая кислоты, основные (диаминомонокарбоновые) аминокислоты – лизин, орнитин, аргинин.
Природа радикала в молекулах аминокислот значительно влияет на свойства белков. Например, наличие полярных групп (-SH, NH2, -OH, COOH, фенольного гидроксила) увеличивает растворимость белков. Кроме того, эти группы принимают участие в образовании связей, формирующих пространственную структуру белка. За счет карбоксильной и аминогруппы многие ферменты обеспечивают кислотный или основный катализ ряда биохимических процессов.
Большинство α-аминокислот синтезируется в организме, но некоторые организм не способен синтезировать, они должны поступать с пищей. Эти аминокислоты называют незаменимыми, в норме их восемь: валин, лейцин, изолейцин, треонин, метилнин, фенилаланин, триптофан, лизин. При некоторых заболеваниях незаменимых аминокислот больше. Так, фенилкетонурия (пировиноградная олигофрения) представляет собой врожденное нарушение обмена веществ, каким-то образом связанное с некоторыми умственными расстройствами. Люди, страдающие этим заболеванием, нуждаются еще в одной незаменимой для них аминокислоте – тирозине, т.к. в отличие от здоровых людей их организм не способен превращать фенилаланин в тирозин.
Источник