125-126
Антраценпроизводные – это большая группа природных соединений, в основе которых лежит ядро антрацена различной степени окисленности.
Растения данной группы принадлежат к различным семействам: крушиновые (жостер слабительный, крушина ольховидная), гречишные (ревень тангутский, щавель конский), бобовые (кассия остролистная), лилейные (различные виды алоэ). Встречаются и в других семействах.
Биологическая роль антраценпроизводных точно не установлена.
Согласно одной точки зрения они выполняют функцию защиты от паразитов, согласно другой – играют роль в окислительно-восстановительных процессах растений, а также способствуют накоплению полисахаридов.
В зависимости от структуры углеродного скелета природные антраценпроизводные делятся на 3 основные группы:
- Мономеры – соединения, содержащие 1 ядро антрацена
- Димеры, в которых 2 ядра антрацена соединены химической связью;
- Конденсированные антраценпроизводные, у которых антраценовые ядра (2 и более) имеют общие химические связи.
В каждой из этих групп могут находиться функциональные группы, которые подразделяются на:
Большинство природных антраценпроизводных относится к типу антрахинона.
Антрахиноны подразделяются на:
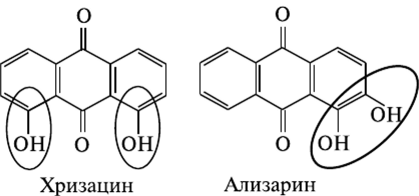
1. Производные ализарина
Встречаются в растениях семейства мареновых, норичниковых. Производные ализарина являются действующими веществами марены красильной и обладают нефролитическим, мочегонным и спазмолитическим действием.
2. Производные хризацина:
Встречаются более часто. Они обнаружены в растениях семейства крушиновые, гречишные, лилейные, зверобойные. В основном обладают слабительным действием.
В молекулах антраценпроизводных могут присутствовать заместители:
Антраценпроизводные могут выполнять роль агликона, причем остаток углевода может находиться в положении один, шесть, восемь, а в случае антронолов и антронов – девять и десять. Гликоном у них чаще всего являются моноуглеводы.
В растениях антраценпроизводные встречаются как в свободном состоянии, так и в виде гликозидов. Антрагликозиды, в основном, являются О- гликозидами, реже С-гликозидами. Локализуются антраценпроизводные, в основном, в сердцевине, сердцевинных лучах и основной паренхиме.
На накопление антраценпроизводных влияют: внешняя среда, возраст растения, фаза развития. Гликозиды антрахинонов больше накапливаются осенью, свободные агликоны – летом и весной. В молодых растениях – восстановленные формы, в старых – окисленные
Биогенез. Предполагают, что антрахиноны образуются в ходе окисления фенолов. Существует также предположение, что они также образуются из уксусной кислоты через стадию образования поликетометиленовой с дальнейшей ее циклизацией.
Как ацетатный путь, так и шикиматный путь реализуется при образовании производных ализарина, а для хризацина, только ацетатный
Физико-химические свойства. Антраценпроизводные – кристаллические вещества желтого, оранжевого или красного цвета.
Свободные агликоны хорошо растворяются в этиловом эфире, хлороформе, бензоле и других органических растворителях; в воде не растворяются, но хорошо растворимы в водных растворах щелочей за счет образования фенолятов.
В форме гликозидов антраценпроизводные хорошо растворяются в воде, еще лучше – в щелочи, хуже – в этаноле и метаноле; нерастворимы в органических растворителях – бензоле, этиловом эфире, хлороформе и др.
При нагревании до 210 о С антраценпроизводные сублимируются. Большинство антраценпроизводных флуоресцирует при возбуждении
УФ и сине-фиолетовым светом. При этом характер флуоресценции зависит как от степени окисленности основного ядра, так и от числа и расположения заместителей: антрахиноны характеризуются, как правило, оранжевой, розовой, красной и огненно-красной флуоресценцией; антроны и антранолы – желтой, голубой, фиолетовой.
Производные антрахинона характеризуются устойчивыми ядрами, поэтому они легко выделяются в виде окрашенных растворов в щелочной среде.
Фитохимические методы анализа ЛРС, содержащего антраценпроизводные.
Выделение антраценпроизводных: из сырья экстрагируют водой или спиртом различной концентрации.
Для получения агликонов гликозиды в растительном материале подвергают гидролизу, нагревая с кислотой (НСL, CH3СООН, Н2SО4) или ферментному расщеплению, затем свободные агликоны извлекают этиловым эфиром или хлороформом.
Качественный анализ:
1. Реакция со щелочью, которую можно провести в 3-х модификациях:
присутствуют в окисленной форме;
10%-ного раствора щелочи образуется вишнево-красное окрашивание.
агликоны в окисленной и восстановленной форме.
Порошок сырья в кипятят несколько минут с 10% спирт. р-ром NaOH и фильтруют. По охлаждении фильтрат подкисляют разведенной HCl до слабокислой реакции и прибавляют 10 мл хлороформа; хлороформный слой окрашивается в желтый цвет; хлороформное извлечение взбалтывают с раствором аммиака, последний окрашивается в вишнево-красный цвет (эмодины), хлороформный слой остается окрашенным в желтый цвет (хризофанол).
- 1,8-диоксиантрахиноны окрашивают аммиачный слой в вишнево-красное окрашивание
- 1,4-диоксиантрахинонов – пурпурное окрашивание
- 1,2-диоксиантрахинонов – фиолетовое окрашивание
2. Реакция сублимации или микровозгонки.
На дно сухой пробирки помещают измельченное сырье и осторожно нагревают, держа пробирку почти горизонтально. Температура сублимации – 210°С.
Сублимат конденсируется на холодных участках пробирки в виде желтых
капель или желтых игольчатых кристаллов. После остывания пробирки к сублимату прибавляют каплю 5%-ного NaОН в этиловом спирте; появляется яркое красное или фиолетовое окрашивание в зависимости от состава антраценпронзводных (образование фенолятов).
Сущность реакции: содержащиеся в растительном материале антрагликозиды при высокой температуре расщепляются с образованием свободных агликонов; одновременно производные антрона и антронола окисляются до антрахинонов, которые возгоняются.
3. Реакция со спиртовым раствором ацетата магния.
Производят экстракцию спиртом при нагревании, а затем добавляют Mg(CH3COO)2, образуется окрашивание:
- 1,2-диоксипроизводные образуют фиолетовое окрашивание;
- 1,4 – пурпуровое;
- 1,6- и 1,8 – оранжево-красное.
4. Методы бумажной хроматографии и ТСХ
При исследовании состава антрагликозидов готовят водные, водно-спиртовые извлечения, а при анализе состава агликонов сырье лучше всего использовать хлороформ.
Хроматографирование осуществляют на пластинках Силуфол и Сорбфил
(системы растворителей: хлороформ-метанол-вода; этилацетат-муравьиная кислота-вода). Хроматограмму высушивают на воздухе, обрабатывают 5% NaОН в этиловом спирте и просматривают при дневном свете и УФ-свете до и после обработки.
Количественное определение:
1. Фотоэлектроколориметрический метод
В основе данного метода лежит способность оксипроизводных антрацена образовывать окрашенные соли со щелочью
1 стадия. Гидролиз и экстракция антраценпроизводных ЛРС. В сырье антраценпроизводные присутствуют в виде гликозидов и агликонов, поэтому сначала необходимо гликозиды гидролизовать до свободных агликонов, затем сумму агликонов извлечь органическим растворителем. ЛРС кипятят с ЛУК, затем экстрагируют орг. растворителем.
2 стадия. Получение окрашенных солей. Эфирное извлечение обрабатывают 5% раствором щелочи, содержащим 2% раствор аммиака; соли переходят в водную фазу.
3 стадия. Окисление восстановленных форм антраценпроизводных. Для этого часть щелочно-аммиачного раствора нагревают на водяной бане.
4 стадия. Измерение оптической плотности на фотоэлектроколориметре. Процентную концентрацию рассчитывают по колибровочному графику
Содержание антраценпроизводных в листьях сенны определяют с некоторыми особенностями:
- Экстракцию проводят при нагревании с водой;
- Окисление восстановленных форм проводят с помощью FeCl3;
- Гидролиз – 50% H2SO4.
2. Весовой метод. Выделяют сумму агликонов антраценпроизводных, сушат и доводят до постоянной массы.
3. Хроматоспектрофотометрический метод позволяет определить индивидуальные производные антрацена. Применяется только для исследовательских работ.
Источник